Расщепление и переработка аммиака
Что такое аммиак?
Аммиак представляет собой соединение азота и водорода. Бесцветный газ с формулой NH3, аммиак обладает резким запахом. Температура кипения аммиака составляет 33,34 градуса Цельсия, поэтому аммиак следует хранить под давлением или при низких температурах. Промышленный аммиак продается либо в виде раствора аммиака, либо в виде сжатого и/или охлажденного безводного жидкого аммиака, транспортируемого в грузовых цистернах или газовых баллонах. В 2014 году мировое производство аммиака составило 176 миллионов тонн. Китай является крупнейшим мировым производителем аммиака с почти одной третью общего объема производства, за ним следуют Индия, Россия и США.
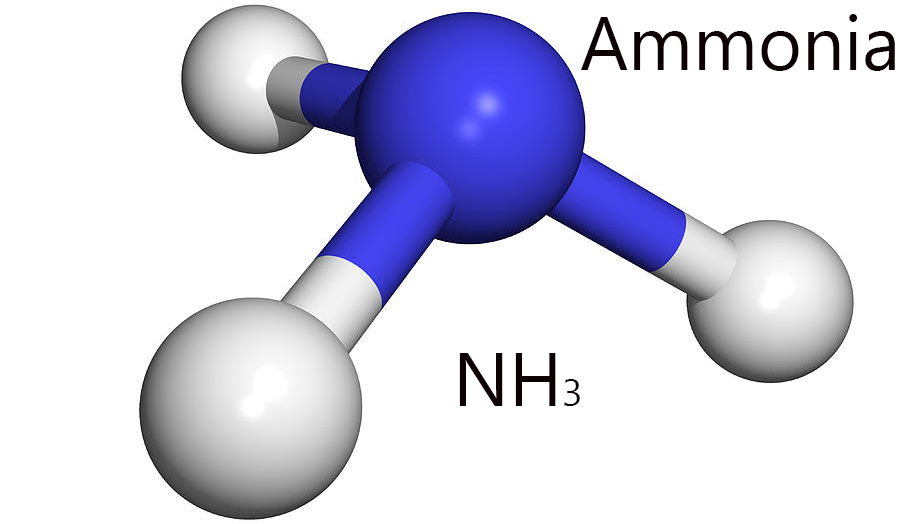
Молекулы аммиака имеют тригонально-пирамидальную форму. Форма молекул учитывает дипольный момент и делает его полярным. Эта полярность позволяет образовывать водородные связи и делает аммиак легко смешиваемым с водой. Центральный атом азота имеет пять внешних электронов с дополнительным электроном от каждого атома водорода. Всего получается восемь электронов или четыре пары электронов, которые расположены тетраэдрически. Три из данных электронных пар используются в качестве связанных пар, оставляя одну единственную пару электронов. Эта длинная пара открепляется легче, чем связанные пары.
Где встречается аммиак?
Произведенный из азотистых животных и растительных веществ, в природе аммиак встречается в ничтожно малых количествах. В форме солей аммония, аммиак также содержится в дождевой воде, а сульфат аммония - в вулканических районах. В Солнечной системе аммиак можно найти на Марсе, Юпитере, Сатурне, Уране, Нептуне и Плутоне.
Аммиак производится из азота и водорода при помощи процесса, называемого процессом Хабера. Процесс Хабера объединяет азот из атмосферного воздуха с водородом из природного газа (метана) для производства аммиака. Созданная реакция является обратимой, и производство аммиака является экзотермическим. Требуемое давление варьируется, но обычно составляет около 200 атмосфер.
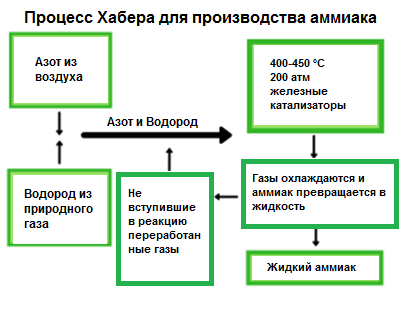
Поскольку при каждом прохождении через реактор только около 15% азота и водорода превращается в аммиак, смесь непрерывно циркулирует до тех пор, пока не будет получен полный объем, составляющий 15%. Поскольку реакция происходит при высоком давлении, проектирование установки довольно затратное. Трубы, защитные оболочки, технологическое оборудование должны быть изготовлены таким образом, чтобы выдерживать экстремальные условия.
Для чего используется аммиак?
Аммиак содержится в продуктах питания, удобрениях, фармацевтических препаратах и экологически чистых продуктах. Подсчитано, что почти 90% аммиака используется в качестве удобрений. При добавлении в почву, аммиак помогает повысить урожайность сельскохозяйственных культур, особенно кукурузы и пшеницы. В качестве чистящего средства NH3 смешивается с водой, образуя гидроксид аммония. Так производят моющее средство общего назначения для многих поверхностей. Аммиак подходит для отчистки многих обычных поверхностей, таких как стекло, фарфор, печи и нержавеющую сталь, дает блеск, не нанося видимых повреждений.
Использование аммиака в пищевых продуктах спорно и в основном он используется в мясной промышленности для уничтожения бактерий, таких как кишечная палочка. Нежная тонкая мраморная говядина изготавливается из жирных говяжьих обрезов, где часто возникает кишечная палочка, которую уничтожают при помощи аммиака. В то время как Министерство сельского хозяйства считает этот процесс эффективным и безопасным, жалобы потребителей не исчезают: из соображений безопасности, до жалоб на вкус и запах говядины, обработанной аммиаком. Использование аммиака при производстве пищевых продуктов является спорным. Как правило, аммиаком обрабатывают только низкокачественные и недорогие продукты из говядины.
В то время как Сиб Контролс может предложить различные системы для переработки и расщепления аммиака (которые мы вскоре рассмотрим), аммиак также используется для снижения других газообразных выбросов. Аммиак применяется в технологии, называемой СКВ (селективное каталитическое восстановление), которая предназначена для снижения выбросов оксида серы (SO2) при сжигании горючих ископаемых. Полученный продукт превращается в сульфат аммония и используется в качестве удобрений.
Чем опасен аммиак?
Аммиак часто встречается в природе и широко используется, но остается едким и опасным веществом при большой концентрации. Поэтому предъявляются строгие требования к отчетности в отношении его производства, хранения и использования в значительных количествах. Диапазон взрываемости аммиака в воздухе составляет 16-25% от объема, при этом аммиак довольно токсичен. Аммиак несет непосредственную угрозу жизни и здоровью. Порог восприятия запаха для аммиака составляет 5 промилле по объему, давая достаточное обонятельное предупреждение о потенциальной опасности. Хотя аммиак не является опасным загрязнителем воздуха (ОЗВ), он регулируется как предшественник загрязнителей воздуха по критериям PM2.5 и PM10. Это связано с тем, что он реагирует с загрязнителями кислых газов, образуя соответствующие соли аммония в атмосфере (такие как: сульфат аммония или нитрат аммония).

Аммиак чрезвычайно токсичен для животных и людей. Аммиак попадает в организм через дыхание, глотание или через кожу и повреждает клетки организма. Воздействие высоких концентраций аммиака может вызвать ожоги слизистой глаз, носа, горла, дыхательных путей и в крайних случаях может вызвать слепоту, повреждение легких и даже смерть. При попадании аммиака при проглатывании он вызывает ожоги рта, горла и желудка.
Как мы можем уменьшить выбросы и переработать аммиак?
Завод по производствуНаиболее эффективной технологией контроля загрязнения от аммиака является влажный скруббер, который часто называют аммиачным скруббером.
Наиболее распространенной кислотой, используемой в скрубберах, является серная кислота, благодаря ее доступности, низкой стоимости и нелетучести. Продукт, образующийся при очистке аммиака серной кислотой, представляет собой сульфат аммония, который является распространенным ингредиентом удобрения. Таким образом, в зависимости от количества, очищаемого NH3, побочный продукт сульфата аммония может быть использован в качестве дополнительного сырья. Аммиачные воздушные скрубберы включают в себя различные способы контактирования газа с жидкостью, такие как насадки скруббера, камеры распыления и водометы. В каждом применении должны учитываться все факторы при выборе оптимальной конструкции.
Для каждого применения скруббер должен быть разработан с учетом конкретных требований заказчика. Остаточный газ, подлежащий очистке, тщательно анализируется для определения оптимальных проектных параметров и обеспечения наилучшего рабочего решения для каждой установки. После тщательного анализа мы предложим несколько вариантов комплектов оборудования скрубберов для очистки дымовых или выхлопных газов в зависимости от оборудования завода, местных норм, местоположения завода и других факторов.
Статьи из серии «Снижение выбросов опасных загрязнителей воздуха»:
Часть 1: БTEк - бензол, толуол, этилбензол и ксилол.
Часть 2: Переработка хлора.
Часть 3: NOx - это загрязняющие воздух оксиды азота.
Часть 4: Переработка свинца.
Часть 5: Промышленные воздушные скрубберы для переработки аммиака.
Часть 6: SOx - это соединения молекул серы и кислорода, включая моноксид серы, диоксид серы и триоксид серы.
Часть 7: Углеводороды - метан, этан, пропан, бутан, пентан, гексан.
Часть 8: Метилмеркаптан, также известный как метантиол.
Часть 9: H2S – высококоррозионноактивный сероводород.
Часть 10: Диметилсульфид – метилтиометан.
Часть 11: Серная кислота – H2SO4.
Часть 12: Оксид этилена – EtO.
Для отправки запроса на скрубберы и другие системы снижения выбросов опасных веществ в атмосферу отправьте нам, пожалуйста, письмо на электронную почту, указанную на странице «Контакты» или заполните контактную форму «Написать нам», расположенную справа на текущей странице данного сайта.